CAR-T疗法已是当下免疫疗法中最热门的领域之一。截至目前,美国FDA已经批准了5款CAR-T疗法上市,用于治疗多种类型的血液癌症。然而,相对于在血液肿瘤中的快速发展,其在实体瘤领域的应用一直难以突破现有局限,间接性阻碍了该疗法在癌症治疗领域的进步与发展。
近日,Nature Reviews Drug Discovery 发表了一篇综述,针对CAR-T疗法治疗实体瘤遇到的挑战和解决策略进行了深度分析。
简单来说:选择合适的靶标和嵌合抗原受体、克服肿瘤微环境的免疫抑制有望成为CAR-T疗法攻克实体瘤的新方向。

寻找合适的“靶标”
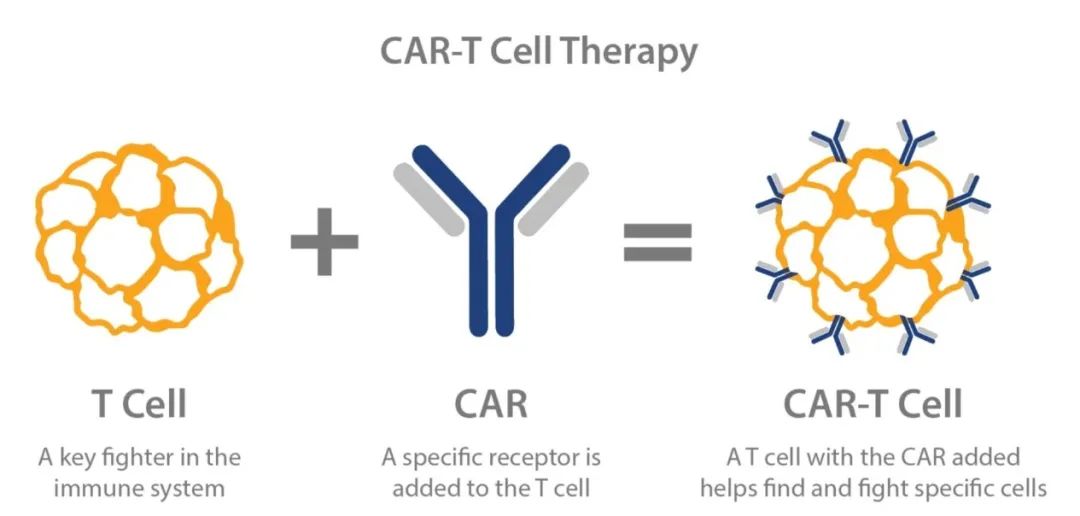
CAR-T,即嵌合抗原受体T细胞免疫疗法。简单来说,CAR-T就是把病人的免疫T细胞在体外通过生物技术改造,令其识别肿瘤细胞表面的抗原,然后把这些细胞输回病人体内,达到识别、杀死癌细胞的治疗效果。
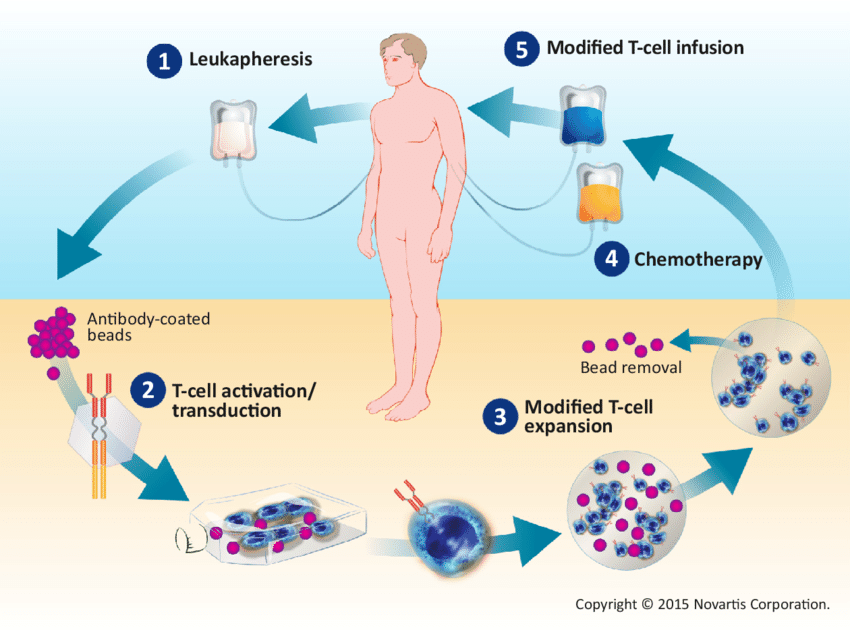 CAR-T细胞治疗流程
CAR-T细胞治疗流程
其中,CAR-T疗法在临床上最大的困境在于“子弹”嵌合抗原受体(CAR)如何打到“靶标”特异性抗原上。对于CAR-T疗法来说,合适的靶标是决定它们的疗效和安全性的主要原因,如果这些靶标表达在健康组织上,那么CAR-T疗法即使与正确的靶标结合,也可能因为杀伤健康细胞而产生强烈的毒副作用。
在实体瘤治疗方面,找到一个只在肿瘤中表达而不在健康组织中表达的特异性靶标十分困难。Nature Reviews Drug Discovery 的综述文章中指出,靶向多个不同靶标的CAR-T疗法在临床试验中出现过严重的毒副作用。
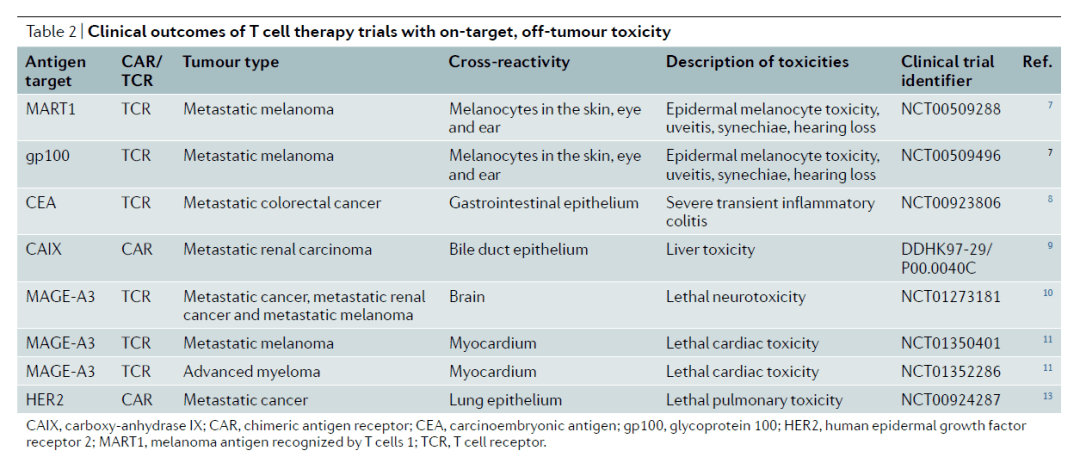 CAR-T疗法在临床试验中出现过因为与非肿瘤组织表达的靶标结合产生的毒副作用(参考资料[1])
CAR-T疗法在临床试验中出现过因为与非肿瘤组织表达的靶标结合产生的毒副作用(参考资料[1])
目前在治疗实体瘤方面,在研细胞疗法靶向的“热门”靶标包括HER2、EGFR、间皮素(mesothelin)、NY-ESO-1、PSMA等等。其中NY-ESO-1属于癌症睾丸抗原(CTA),它通常只在睾丸或卵巢组织中表达,然而在多种癌症中,这种抗原会重新开始表达。因此,它为T细胞疗法提供了一种特异性强,而毒副作用弱的靶标抗原。
