 ▲智能CAR-T细胞疗法的设计和作用机理,通过与特异性抗原结合的synNotch系统调节识别周围癌细胞的CAR的表达
▲智能CAR-T细胞疗法的设计和作用机理,通过与特异性抗原结合的synNotch系统调节识别周围癌细胞的CAR的表达
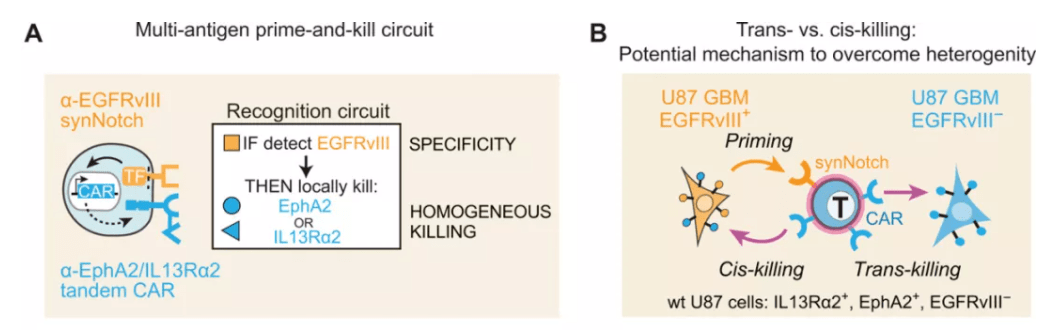
这个设计同时可能解决CAR-T治疗实体瘤时的另一个挑战,那就是实体瘤由于它的异质性,并不是所有细胞都会表达CAR-T疗法靶向的靶标。这一synNotch系统产生的作用被称为“旁观者效应”(bystander effect)。它的意思是让CAR-T细胞在特异性地到达肿瘤后,能够杀伤周围不表达特异性靶标的肿瘤细胞,从而增强杀伤效果。在小鼠模型中,利用synNotch系统设计的“智能”CAR-T疗法也确实显示出了更好的效果。
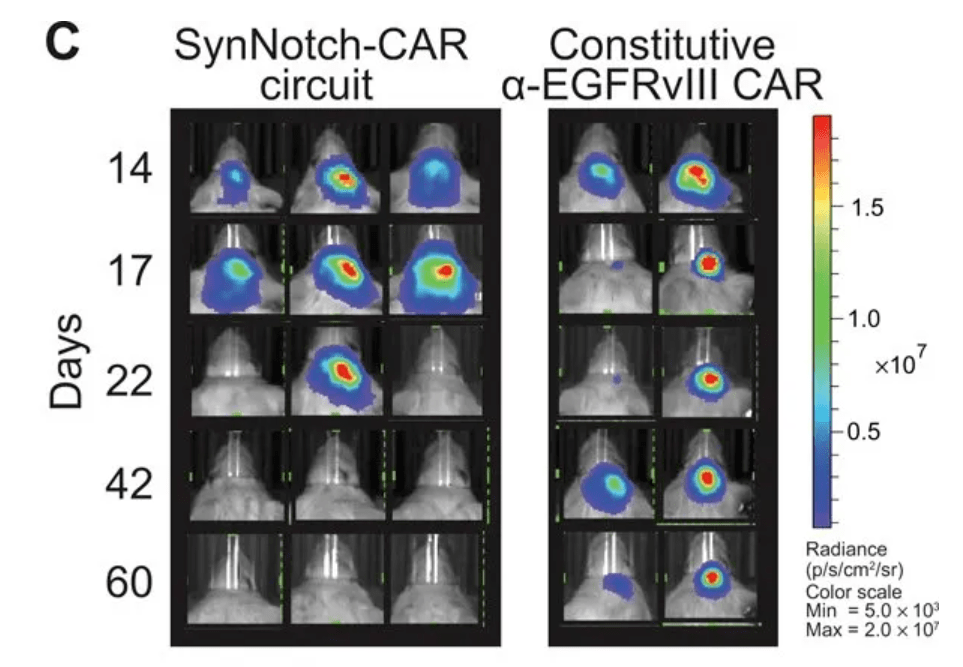 ▲在小鼠肿瘤模型中,植入了synNotch系统的CAR-T细胞(左图)表现出更强的抗癌能力(图片来源:参考资料[4])
▲在小鼠肿瘤模型中,植入了synNotch系统的CAR-T细胞(左图)表现出更强的抗癌能力(图片来源:参考资料[4])
除了synNotch系统以外,科学家们还设计了多种其它的“分子开关”,它们的作用包括让CAR-T细胞能够识别多种不同的抗原;在识别健康细胞表达的抗原后失活;或者可以通过药物调控CAR-T细胞的活性。这些对CAR-T细胞的改造都有助于提高它们治疗实体瘤时的特异性并降低毒副作用。
克服肿瘤微环境的免疫抑制
实体瘤与血液癌症相比,一个重要的不同点是实体瘤周围形成的肿瘤微环境(TME)。肿瘤微环境中包含着多种具有免疫抑制能力的细胞,例如调节性T细胞(Treg)、肿瘤相关巨噬细胞(TAM)等等。肿瘤微环境中还过度表达TGFβ、IL-10、IL-4等具有免疫抑制能力的细胞因子。这些因素构成的免疫抑制环境能够显著降低CAR-T细胞的效力。
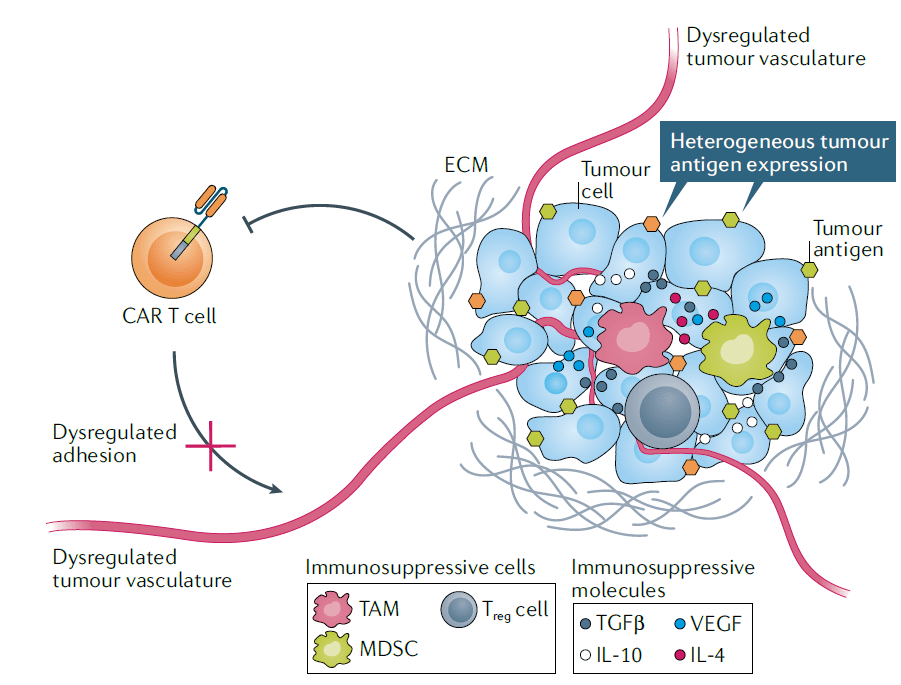 ▲实体瘤的肿瘤微环境中可能影响CAR-T细胞效力的多种因素(图片来源:参考资料[1])
▲实体瘤的肿瘤微环境中可能影响CAR-T细胞效力的多种因素(图片来源:参考资料[1])
为了克服肿瘤微环境的影响,科学家们给新一代的CAR-T疗法加上了对抗免疫抑制的“武器”。这些“武装起来的CAR-T细胞”(armored CAR-T cells)正在成为T细胞疗法开发的一个趋势。
科学家们为CAR-T细胞添加的“武器”多种多样。例如,一个对抗TGFβ免疫抑制功能的方法是在CAR-T细胞中表达能够阻断TGFβ信号传导的显性负性受体(dominant negative receptor,DNR)。这种DNR能够与细胞中本来存在的TGFβ受体竞争和TGFβ结合,但是与TGFβ结合后不会引发下一步的信号传导。由著名CAR-T疗法先驱Carl June博士联合创建的Tmunity公司开发的一款新一代CAR-T疗法就采用了表达阻断TGFβ信号通路的DNR的策略。这款靶向PSMA的CAR-T疗法在治疗前列腺癌患者的临床试验中表现出了临床活性。这一策略也可以用于阻断PD-1介导的免疫抑制信号通路。
