CAR-T细胞疗法是近年来癌症治疗领域的重大突破之一。迄今为止,美国FDA已经批准了5款CAR-T疗法,用于治疗多种类型的血液癌症。然而,在治疗实体瘤方面,目前仍然没有任何获批的CAR-T疗法。那么,CAR-T疗法在治疗实体瘤方面遇到了哪些和治疗血液癌症时不同的挑战?科学家们又在采用哪些策略来攻克这些挑战。近日,Nature Reviews Drug Discovery发表了一篇综述,对CAR-T疗法治疗实体瘤遇到的挑战和解决策略进行了深度分析。今天,药明康德内容团队将结合公开资料,介绍这一综述的精彩内容。

选择CAR-T细胞疗法合适的靶标
对于CAR-T疗法来说,合适的靶标是决定它们的疗效和安全性的主要原因。因为CAR-T细胞表面表达的嵌合抗原受体(CAR)会将细胞引导到表达靶标抗原的细胞,如果这些靶标表达在健康组织上,那么CAR-T疗法即使与正确的靶标结合,也可能因为杀伤健康细胞而产生强烈的毒副作用。
目前治疗血液癌症的获批CAR-T疗法都是在靶向B淋巴细胞上的特异性抗原(例如CD19和B细胞成熟抗原),而这些疗法的一个常见副作用是导致健康B细胞的清除,这是这些CAR-T疗法的已知副作用之一,不过它们仍然具有可以接受的安全性。
而在治疗实体瘤方面,找到一个只在肿瘤中表达而不在健康组织中表达的特异性靶标十分困难。Nature Reviews Drug Discovery的综述文章中指出,靶向多个不同靶标的CAR-T疗法在临床试验中出现过严重的毒副作用。
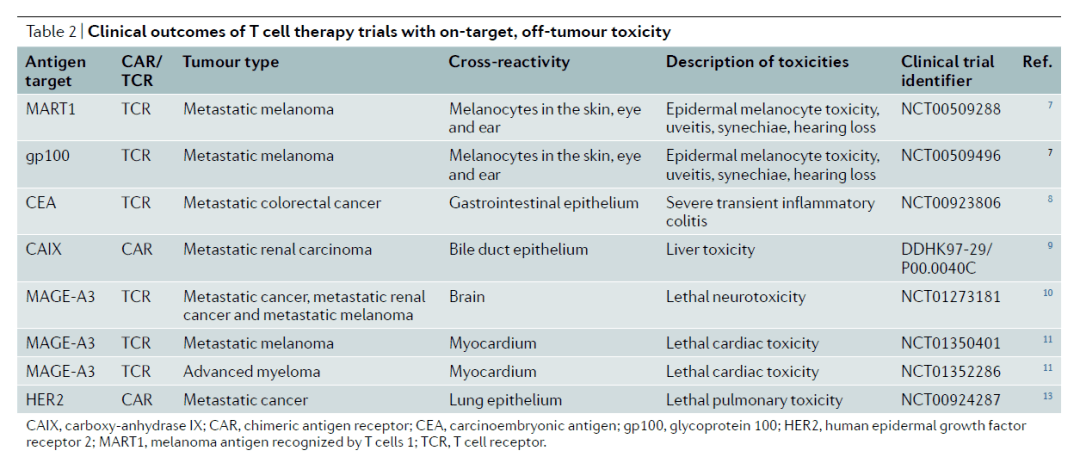 ▲CAR-T疗法在临床试验中出现过因为与非肿瘤组织表达的靶标结合产生的毒副作用(图片来源:参考资料[1])
▲CAR-T疗法在临床试验中出现过因为与非肿瘤组织表达的靶标结合产生的毒副作用(图片来源:参考资料[1])
除了寻找特异性强的靶标以外,提高CAR-T疗法特异性的另一个方法是对CAR-T细胞表达的受体进行改造,从而增强它们识别肿瘤细胞的能力。例如,近日登上Science Translational Medicine封面的一项研究中。美国加州大学旧金山分校(UCSF)的研究人员设计了一种“智能”的CAR-T细胞。利用称为synNotch的基因表达调控系统,先引导CAR-T细胞识别在部分癌细胞中高度特异性表达的EGFRvIII,然后激发识别EphA2或IL13Rα2的CAR的表达。这两种蛋白在所有癌细胞中都表达,从而可以指挥T细胞消灭所有的癌细胞。虽然EphA2或IL13Rα2也在部分健康细胞中表达,但是由于在synNotch系统的调节下,识别它们的CAR只会在迁移到肿瘤中的T细胞上表达,因此健康细胞不会受到这些CAR-T细胞的攻击。
