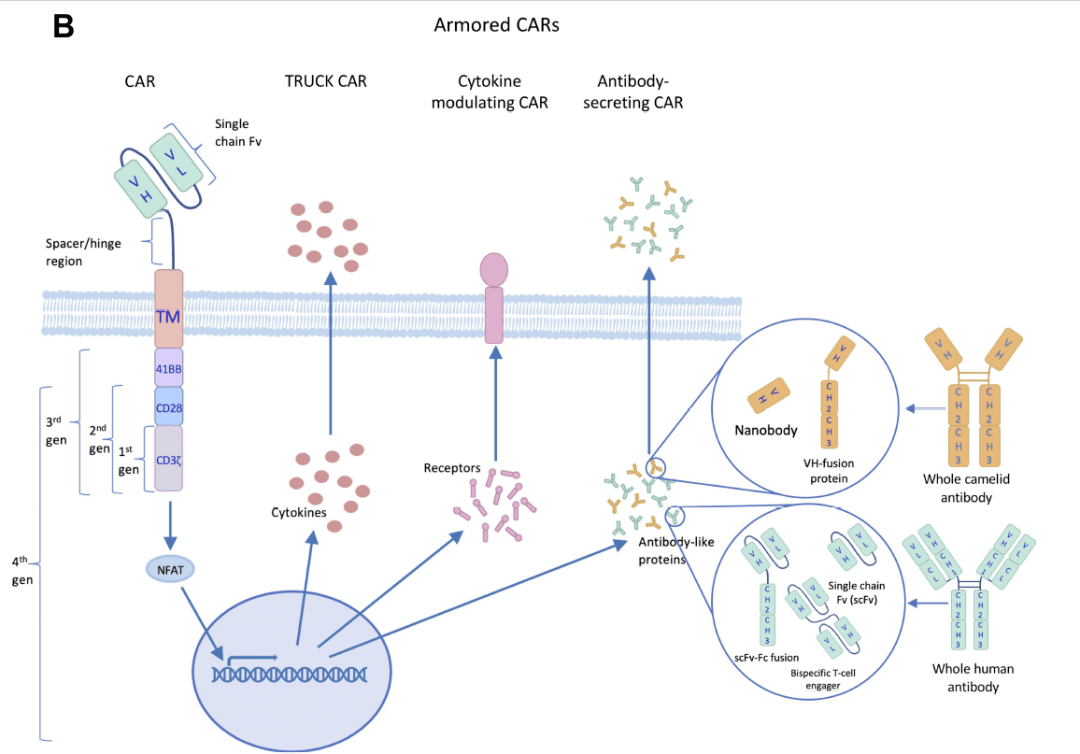
 ▲“武装”CAR-T疗法的多种策略(图片来源:参考资料[3])
▲“武装”CAR-T疗法的多种策略(图片来源:参考资料[3])
另一种对抗肿瘤微环境的方法是让CAR-T细胞同时表达能够改变肿瘤微环境特征的促炎症细胞因子,例如IL-12,IL-18和IL-23。IL-12和IL-18能够提高促炎症的细胞因子IFN-γ的分泌,而IFN-γ则能够进一步促进巨噬细胞释放IL-12,从而产生一个正反馈的回路。以往的研究结果显示,全身性使用IL-12和IL-18均会导致很强的毒性,如果CAR-T细胞持续表达这些因子可能也会产生毒性,因此目前的设计是让CAR-T细胞在与靶标结合之后驱动细胞因子的表达,从而将细胞因子的作用限制在肿瘤附近。
CRISPR基因编辑技术的普及也为改造CAR-T细胞疗法提供了一种新的工具,Tmunity公司利用基因编辑敲除T细胞中的内源T细胞受体(TCR)和PD-1受体,然后再表达靶向NY-ESO-1抗原的TCR。利用这一技术开发的TCR细胞疗法已经在临床试验中表现出积极的疗效。CRISPR基因编辑技术不但有可能帮助敲除可能影响T细胞疗法功能的基因,而且可以作为筛选工具,发现目前未知的全新T细胞功能调控因子。
结语
目前,科学家拥有多种调节CAR-T疗法特性的工具,对它们的特异性、可控性、安全性、以及效力做出改进。利用最新的前沿技术对CAR-T疗法的多方面改进有望克服治疗实体瘤需要面对的多重障碍。另一方面,在CAR-T细胞疗法以外,科学家们也在开发其它形式的免疫细胞疗法,它们包括可以识别肿瘤细胞内抗原的TCR细胞疗法,利用先天免疫细胞的CAR-M疗法。Iovance biotherapeutics公司开发肿瘤浸润淋巴细胞(TIL)疗法在治疗晚期宫颈癌和黑色素瘤患者的关键性临床试验中也已经表现出积极的疗效。
我们预祝免疫细胞疗法领域的进步早日攻克治疗实体瘤面对的挑战,为更多患者造福。
参考资料:
[1] Hou et al. (2021). Navigating CAR- T cells through the solid- tumour microenvironment. Nature Reviews Drug Discovery, https://doi.org/10.1038/s41573-021-00189-2
[2] Researchers in biotech, academia and Big Pharma are offering puzzle pieces to crack CAR-T for solid tumors. Will they ever snap together? Retrieved May 25, 2021, from https://endpts.com/researchers-in-biotech-academia-and-big-pharma-are-offering-puzzle-pieces-to-crack-car-t-for-solid-tumors-will-they-ever-snap-together/
[3] Hawkins et al., (2021). Armored CAR T-Cells: The Next Chapter in T-Cell Cancer Immunotherapy. Biologics: Targets and Therapy, https://doi.org/10.2147/BTT.S291768
[4] Choe et al., (2021). SynNotch-CAR T cells overcome challenges of specificity, heterogeneity, and persistence in treating glioblastoma. Science Translational Medicine, DOI:10.1126/scitranslmed.abe7378
