为了研究Pu.1是否参与ARC的发育,研究人员使用了两种不同的Pu.1 shRNA慢病毒,在分选后的ARC中进行Pu.1 KD检测。qRT-PCR结果表明两种Pu.1 shRNA的敲低效率均有90%左右。在脂肪细胞分化后,与对照shRNA处理的ARC相比,Pu.1 shRNA处理的ARC显示出更高的脂质积累。并且Pu.1 KD细胞的Sox9表达水平降低了2倍,脂肪生成标志物基因C/ebpδ和Pparγ增加了4倍以上(Fig 4F)。综上所述,这些数据表明,Pu.1对衰老过程中ARC的发育至关重要。
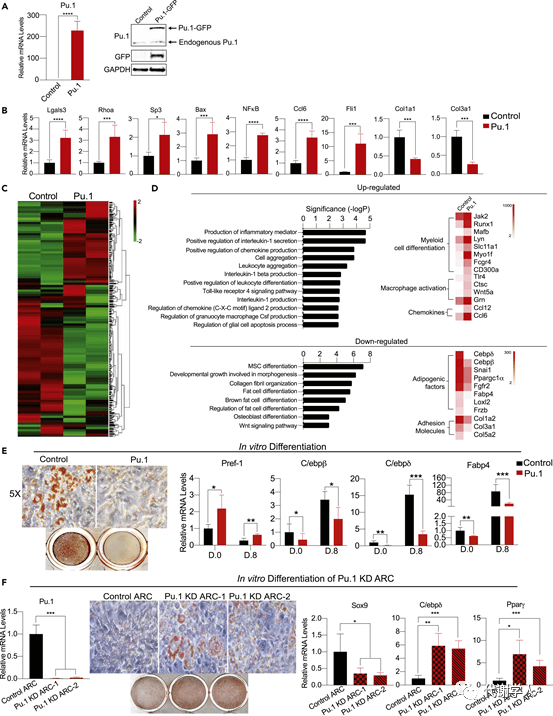 Fig 4 | Pu.1在ARC形成和功能中的作用
Fig 4 | Pu.1在ARC形成和功能中的作用
5 Pu.1是ARC抑制邻近细胞脂肪生成功能的关键转录因子
研究人员检测ARC对邻近细胞的抑制作用是否需要Pu.1,于是将3T3-L1细胞在对照ARC和Pu.1-KD-FACS分类的ARC的生长条件培养基中培养。诱导分化后,在Pu.1 KD ARC生长培养基中培养的细胞脂质积累水平高于对照组。qRT-PCR结果表明在分化第0天,与对照组相比,Pu.1KD ARC培养液处理的3T3-L1细胞的Sox9基因表达水平更低,而C/ebpδ、Pparγ和Fabp4表达水平更高。在分化第8天,在Pu.1 KD ARC组的Sox9表达降低约3倍,C/ebpδ、Pparγ和Fabp4水平升高4倍(Fig 5A)。这些结果说明,Pu.1在ARC抑制邻近细胞成脂分化过程中起关键作用。
为了进一步验证Pu.1是否是ARCs对邻近细胞的抑制作用的关键因子,研究人员进行了体内移植实验。研究人员通过感染过表达Pu.1慢病毒,然后进行抗性筛选,构建稳定过表达Pu.1的3T3-L1细胞。该细胞系不仅Pu.1表达水平升高,而且Lgal3、TNF-α、Ccl6、Flil的表达水平也升高,粘附蛋白如Colla1、Col5a1表达降低(Fig S4)。因此,稳定过表达Pu.1的3T3-L1细胞表现出类似Fig 4中瞬时表达Pu.1的3T3-L1细胞的基因表达谱。然后,将表达GFP的3T3-L1细胞与表达Pu.1的3T3-L1细胞混合,然后将它们与基底胶混合,皮下注射到免疫缺陷型的SCID小鼠中。12天后,收集移植后的小鼠脂肪进行分选,再检测免疫荧光和qRT-PCR(Fig 5B)。移植物采用LipidTox或DAPI染色。对照组GFP+ 3T3-L1细胞经脂质染色形成大量脂肪细胞。
相比之下,过表达Pu.1的3T3-L1细胞形成的脂质明显降低,表明Pu.1可以显著抑制脂肪生成。更重要的是,当GFP+ 3T3-L1细胞与稳定表达的Pu.1细胞一起植入时,与单独植入GFP+细胞相比,混合稳定表达的Pu.1细胞和GFP+ 细胞形成的脂质更低(Fig 5C),qRT-PCR显示C/ebpβ、C/ebpδ、Pparγ和Fabp4显著降低。这些结果表明,过表达Pu.1不仅抑制脂肪生成,而且抑制体内邻近前脂肪细胞(preadipocytes)的分化。综上所述, Pu.1是ARC发育及功能作用的关键因子,并且ARC可以抑制邻近前脂肪细胞(adipose precursors)的分化。
